
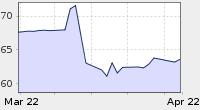
Pertama, teknik kulit (K, L, M, N,...) memiliki banyak kekurangan. Itu mengingatkan saya akan sesuatu pernyataan: setiap teori pastilah punya celah untuk disalahkan.Celah Dalam Teknik KulitCelah dalam teknik kulit itu, sangat terlihat baik disadarikah? Atau munkin tidak. Jelas-jelas celah itu terlihat...


 https://orcid.org/0009-0001-5292-8615
https://orcid.org/0009-0001-5292-8615

